膵β細胞で迅速に遺伝子をノックアウトする技術(βCas9法)を確立
2023年09月23日13時40分 / 提供:PR TIMES![]()
― CRISPR-Cas9システムとアデノ随伴ウイルスベクターのコンビネーション ―
順天堂大学大学院医学研究科 代謝内分泌内科学の植木響政助手、西田友哉准教授、綿田裕孝教授、および北里大学医学部内分泌代謝内科学の共同研究グループは、膵β細胞でのみ特異的に遺伝子をノックアウトする新しい技術を確立しました。膵β細胞の機能解析は糖尿病研究の中心であり、その遺伝子を特異的にノックアウトすることはきわめて重要な研究手法です。しかし、それには莫大な費用と時間を要するという難点がありました。そこで研究グループは、CRISPR-Cas9システムと、生体への遺伝子導入に頻用されるアデノ随伴ウイルス(AAV)ベクターを組み合わせることで、従来の方法と比較し迅速かつ簡便に膵β細胞特異的遺伝子ノックアウトマウスを作製する技術「βCas9法」を確立しました。このβCas9法により様々な膵β細胞特異的遺伝子ノックアウトマウスを迅速に作製することができ、糖尿病治療における研究を大きく加速することが期待されます。
本研究成果のポイント
膵β細胞特異的遺伝子ノックアウト技術であるβCas9法を確立
若年発症成人型糖尿病原因遺伝子のノックアウトによりβCas9法の有用性を検証
膵β細胞機能不全の研究を通じた2型糖尿病の病態解明を大きく加速させることを期待
背景
遺伝子が特定の組織で欠損したマウス(条件付き遺伝子ノックアウトマウス(*1))を作製することは、その遺伝子が特定の組織や臓器で果たす役割を解明する上できわめて有用な手段であり、膵β細胞(*2)の特異的遺伝子ノックアウトマウスの作製を通じて、2型糖尿病(*3)の病態には膵β細胞の機能不全が深く関与することが明らかにされてきました。
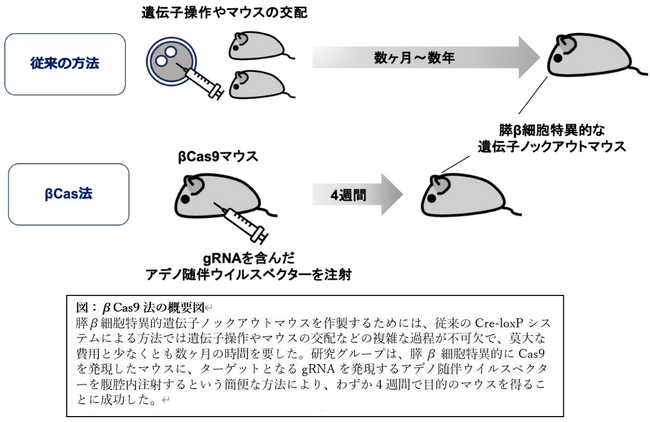
膵β細胞特異的遺伝子ノックアウトマウスを作製する際には、Cre-loxPシステム(*4)を用いることが一般的ですが、このシステムは目的遺伝子の改変や膵β細胞特異的遺伝子組換え誘導が可能なマウスの交配といった過程を必要とし、莫大な費用と時間を要するという難点がありました。
そこで、研究グループは、近年注目されているCRISPR-Cas9システム(*5)と生体の遺伝子導入で頻用されるアデノ随伴ウイルス(AAV)ベクター(*6)を組み合わせることにより、膵β細胞特異的遺伝子ノックアウトマウスを作製することを目指しました。
内容
本研究では、まず膵β細胞特異的にCas9およびそのレポーター(*7)であるEGFP(緑色蛍光タンパク)を発現するマウス(βCas9マウス)を作製しました。次に、EGFPを標的としたgRNAを発現するAAVベクターを腹腔内に注射し、遺伝子ノックアウトの効率を検討しました。AAVの投与4週後に膵β細胞のEGFP発現を観察したところ、約80%の効率でEGFP遺伝子がノックアウトされることを確認しました。また、若年発症成人型糖尿病4型(MODY4)(*8)の原因遺伝子として知られるPdx1をターゲットとしたgRNA(gPdx1)を、AAVベクターを用いた同様の方法でβCas9マウスに導入しました。そのマウスでは膵β細胞でのPdx1の発現低下とブドウ糖負荷試験での血糖上昇を認めました。さらにgPdx1が導入された膵β細胞では、本来分泌されるインスリンの発現が低下し、膵α細胞から特異的に分泌されるグルカゴンの発現が増加していることが確認され、膵β細胞の分化転換(*9)が生じていると考えられました。この結果は、以前に得られていた膵β細胞特異的Pdx1ノックアウトマウスの解析結果と一致することから、本手法の有用性が確認されました。研究グループは、βCas9マウスとAAVベクターによるこの新しい膵β細胞特異的遺伝子ノックアウトの技術をβCas9法と命名しました。
今後の展開
膵β細胞特異的遺伝子ノックアウトマウスの作製のためのβCas9法は、従来の方法であるCre-loxPシステムと比較し、AAVベクターの腹腔内注射というきわめて容易な手技を用いて、数週間という非常に短期間での膵β細胞特異的遺伝子ノックアウトを可能にした画期的な技術です。様々な遺伝子ノックアウトを簡便に試すことにより、遺伝子組み換えマウスの作出による本格的な検討に入る前のスクリーニングとして、膵β細胞研究を大きく加速させることが期待できます。
[画像: https://prtimes.jp/i/21495/579/resize/d21495-579-5049449f64ebd1db2eae-0.png ]
用語解説
*1 条件付き遺伝子ノックアウトマウス:生体内の特定の組織でのみ遺伝子が欠損したマウス。全身の臓器で遺伝子が欠損したマウスと比べ、その遺伝子の組織や臓器に固有の役割を検証することができ、特に全身の欠損で出生しなくなる(胎生致死の)マウスの解析で威力を発揮する。
*2 膵β細胞:生体内で唯一の血糖降下ホルモンであるインスリンを分泌する内分泌細胞であり、膵ランゲルハンス島(膵島)に存在する。膵島には血糖上昇ホルモンであるグルカゴンを分泌するα細胞も存在し、インスリンとともに血糖の調節を担う。
*3 2型糖尿病:インスリンの相対的な作用不足に基づく慢性高血糖を示す糖尿病の一病型。インスリン効果の低下(インスリン抵抗性)と膵β細胞の機能不全がその病因の中核をなす。
*4 Cre-loxPシステム:DNA組換え酵素であるCreリコンビナーゼにより、loxP配列と呼ばれる特定の塩基配列で挟み込まれたDNA配列が除去されるシステム。特定の組織でCreリコンビナーゼを発現させることにより、条件付きノックアウトマウスの作製に利用される。
*5 CRISPR-Cas9システム:DNA切断酵素であるCas9が、特定の塩基配列を認識するガイドRNA(gRNA)配列に基づきDNAを切断することを利用し、任意のDNA配列を改変することができる遺伝子編集技術。
*6 アデノ随伴ウイルス(AAV)ベクター:内部に1本鎖DNAを含む小型のウイルス。AAVは病原性がないと考えられているため、マウスや細胞に対する遺伝子ベクター(運び屋)として遺伝子導入に頻用される。
*7 レポーター:ある遺伝子の発現を可視化するための外来遺伝子。目的遺伝子の下流(本研究ではCas9)に蛍光レポーター(本研究ではEGFP)を連結して挿入することで、目的遺伝子と並行してレポーターが発現するため、蛍光観察によりその発現の程度を視認できる。
*8 若年発症成人型糖尿病4型(MODY4):常染色体顕性で発症する若年発症成人型糖尿病(MODY)の病型の一つ。その原因として、膵発生に必須な遺伝子であるPdx1遺伝子の機能障害が同定されている。
*9 分化転換:既に分化・成熟したある種の細胞が、他のタイプの細胞に完全に形質転換する現象。本研究では、Pdx1欠損により膵β細胞がα細胞に分化転換したと考えられる。
研究者のコメント
糖尿病は、国内の患者数が約1000万人に及ぶと推定されており、新薬の開発が盛んに行われている分野です。一方で未だ根本的な治療法が見出されておらず、膵β細胞を中心とした病態解明が不十分であることがその要因の一つであると考えられます。本研究で確立した技術は、そうした糖尿病の病態解明や新規創薬をさらに加速させるツールとして、今後の応用が期待されます。
本研究で得られた結果は糖尿病研究の全体からみれば小さな知見ですが、このような小さなデータの集積が新たな治療を生み出し、最終的に患者に還元されることを切に願っています。
原著論文
本研究は「Diabetes」誌のオンライン版に2023年8月25日付で公開されました。
タイトル:Establishment of Pancreatic Beta Cell-specific Gene Knockout System Based on CRISPR-Cas9 Technology with AAV8-mediated gRNA Delivery
タイトル(日本語訳): CRISPR-Cas9技術に基づくアデノ随伴ウイルス(AAV)を用いた膵β細胞特異的な遺伝子ノックアウトシステムの確立
著者:Kyosei Ueki1, Yuya Nishida1, Shuhei Aoyama1, Hirotsugu Uzawa1, Akiko Kanai1, Minami Ito1, Koki Ikeda1, Hitoshi Iida1, Takeshi Miyatsuka2, Hirotaka Watada1
著者(日本語表記): 植木響政1、西田友哉1、青山周平1、鵜澤博嗣1、金井晶子1、伊藤南1、池田恒基1、飯田雅1、宮塚健2、綿田裕孝1
著者所属:1)順天堂大学大学院医学研究科 代謝内分泌内科学 2)北里大学医学部 内分泌代謝内科学
DOI: 10.2337/db23-0445
本研究はJSPS科研費20K08917, 20H0375の支援を受けて実施されました。
なお、本研究にご協力いただいた皆様には深謝いたします。
企業プレスリリース詳細へ
PR TIMESトップへ