【横浜市立大学】タンパク質品質管理に関わる小胞体内の新区画を発見
2025年11月12日09時00分 / 提供:Digital PR Platform![]()
~糖尿病、ALS、アルツハイマー症などに対峙する革新的治療法開発に光~
【発表のポイント】
小胞体内に存在し、不良タンパク質の凝集を抑制するなどの機能をもつプロテインジスルフィドイソメラーゼ(PDI)ファミリーの中から、カルシウム依存的に相分離する因子PDIA6を発見しました。
相分離したPDIA6はその中で未成熟インスリンの凝集を抑制しつつ、立体構造形成を促進し、成熟インスリンの効率的な生産に不可欠な役割を果たしていることが明らかとなりました。
本機構の破綻が引き起こす種々の疾病の成因解明につながると期待されます。
【概要】
細胞内におけるタンパク質品質管理の破綻は多くの疾患を引き起こします。東北大学学際科学フロンティア研究所、大学院生命科学研究科(兼務)の奥村正樹准教授(国際卓越研究者:ディスティングイッシュトアソシエイトプロフェッサー)(注1)らの研究グループは、日韓英の17研究グループによる国際共同研究により、小胞体(注2)内に局在しカルシウム依存的に相分離(注3)するPDIA6が、その区画内での未成熟インスリンの凝集形成を抑える役割を果たしていることを見いだしました。この発見は、これまで一様と考えられてきた小胞体内が区画化されているという概念変革を与えるものです。
PDIA6の相分離によるタンパク質品質管理機構に対する理解が深まったことで、筋萎縮性側索硬化症(ALS)や糖尿病などの成因解明や、革新的治療法開発の加速が期待されます。
本成果は、2025年11月11日にNature Cell Biologyのオンライン速報版で公開されました。また、本成果は同誌の表紙に選出される見込みです。
なお本成果は、東北大学大学院生命科学研究科の渡部マイ大学院生、倉持円来大学院生、学際科学フロンティア研究所の金村進吾助教、韓国基礎科学支援研究院のLee Young-Ho教授、Lin Yuxi研究員、徳島大学先端酵素学研究所の齋尾智英教授、松﨑元紀助教、立命館大学生命科学部の萬年太郎助教、関西学院大学生命環境学部の鎌田優香助教らとの共同研究によるものです。
【詳細な説明】
研究の背景
細胞内には、タンパク質の立体構造の形成反応を補助するタンパク質品質管理機構が備わっており、多くの生体機能の維持に寄与しています。この品質管理機構が破綻すると、アルツハイマー症など様々な神経変性疾患(注4)や2型糖尿病を引き起こすと考えられています。しかしながら、いまだ細胞内のタンパク質品質管理の仕組みの多くは未解明であり、各疾患を標的とした創薬開発が待たれています。
プロテインジスルフィドイソメラーゼ(PDI)ファミリー(注5)のひとつであるPDIA6は、哺乳動物細胞の小胞体内で、立体構造形成前のタンパク質にジスルフィド結合(注6)を導入する機能や、誤って形成されたジスルフィド結合を修復するジスルフィド異性化酵素としての機能、不良タンパク質の凝集を抑制するシャペロン(注7)機能を有することが知られていました。しかし、タンパク質品質管理機構における具体的な役割についての全容は不明でした。
今回の取り組み
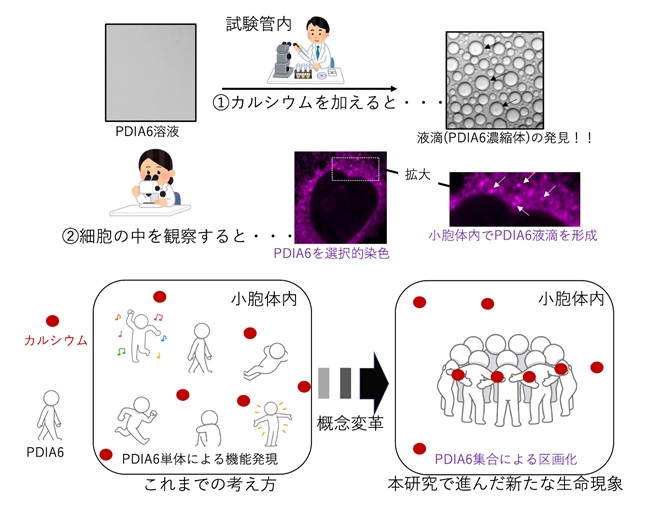
ヒト由来のPDIファミリーには20種類以上の因子が存在しますが、本研究ではその中から、カルシウム依存的に相分離を示すPDIA6を発見しました(図1)。相分離し、集合化したPDIA6は、他のシャペロンやジスルフィド結合異性化酵素、未成熟インスリンを濃縮し、その区画内で未成熟インスリンの凝集形成を抑制するとともに、立体構造形成(フォールディング)を促進する機能を有することが明らかとなりました。小胞体内のPDIA6集合体の有無における成熟インスリン生産の実験から、PDIA6集合体を形成した状態では、成熟インスリンが多く生産されることに対し、PDIA6が集合体を形成せず単体のみ存在している状態では、小胞体内で未成熟インスリンの凝集体が蓄積し、成熟インスリンの生産量が低下することがわかりました(図2)。
本研究により発見されたPDIA6の相分離現象は、小胞体内が従来考えられていたような一様な環境ではなく、小胞体内が区画化され、その場所でインスリンなどタンパク質を生産する品質管理の役割を担っていることがわかりました。
以上を踏まえ、本研究グループはこの場所を「タンパク質品質管理顆粒」と命名しました。
今後の展開
糖尿病や、パーキンソン病やアルツハイマー症など種々の神経変性疾患は、体内で構造異常タンパク質が過剰に蓄積することで引き起こされることが知られています。本研究は、小胞体内の高効率・高精度なタンパク質品質管理に関し、生命現象の新たな基礎知見を提示しました。今後ALSやアルツハイマー症などの神経変性疾患や2型糖尿病などの疾患に関し、PDIA6相分離を標的にした創薬への展開が期待されます。
[画像1]https://digitalpr.jp/simg/1706/122187/500_392_202511111146166912a37853810.jpg
図1. カルシウム依存的なPDIA6の集合化(相分離)
上図:試験管内実験によるPDIA6の「相分離」現象の発見:PDIA6溶液へのカルシウムの添加によって集合体(液滴)を形成。
下図:細胞内小器官のひとつである小胞体内で観測されたPDIA6の液滴:PDIA6が単体だけでなく集合体としても存在することを世界で初めて発見。
[画像2]https://digitalpr.jp/simg/1706/122187/600_396_202511111146206912a37c11e7b.jpg
図2. 細胞内PDIA6集合体による成熟インスリンの高効率生産
PDIA6集合体の有無による成熟インスリンの生産量の違い:PDIA6が集合体を形成した状態では成熟インスリンが多く生産される。一方、集合体を形成していない単体のPDIA6のみが存在する環境では、未成熟インスリンの凝集体が蓄積し、成熟インスリン生産の効率が低い。
【謝辞】
研究代表者:奥村 正樹(東北大学 学際科学フロンティア研究所 准教授(国際卓越研究者:ディスティングイッシュトアソシエイトプロフェッサー))
科学技術振興機構(JST) 創発的研究支援事業 JPMJFR201F; 日本学術振興会(JSPS) 基盤研究(B)JP22H02205、JP25K01902; 学術変革領域研究(B)JP21H05095; 国際共同研究加速基金(海外連携研究)JP23KK0105; 公益財団法人 上原記念生命科学財団; 公益財団法人 内藤記念科学振興財団; 公益財団法人 武田科学振興財団; 公益財団法人 持田記念医学薬学振興財団; 公益財団法人 テルモ生命科学振興財団; 公益財団法人 アステラス病態代謝研究会; 公益財団法人 鈴木謙三記念医科学応用研究財団; 公益財団法人 旭硝子財団; 公益財団法人 第一三共生命科学研究振興財団; 公益財団法人 三井住友海上福祉財団; 公益財団法人 小野医学研究助成; 公益財団法人 中谷財団; 白石科学振興会
研究代表者:齋尾 智英 (徳島大学 先端酵素学研究所 教授)
日本学術振興会(JSPS) 基盤研究(B)JP23K23824; 学術変革領域研究(B) JP21H05094; 科学技術振興機構(JST) 創発的研究支援事業 JPMJFR204W
研究代表者:Lee Young-Ho (Korea Basic Science Institute)
National Research Foundation of Korea(RS-2024-00356469, RS-2022-NR069719, RS-2021-R057690)、Korea Basic Science Institute fund(A423310, A412580, A439200, C512120, C523200, C539200)
研究代表者:松﨑 元紀 (徳島大学 先端酵素学研究所 助教)
日本学術振興会(JSPS) 新学術領域研究(研究領域提案型) JP22H04847
研究代表者:萬年 太郎 (立命館大学 生命科学部 助教)
日本学術振興会(JSPS) 基盤研究(C) JP20K06493; JP24K09333
研究代表者:村岡 貴博 (東京農工大学 大学院工学研究院応用化学部門 教授)
日本学術振興会(JSPS) 学術変革領域研究(B)JP21H05093; 科学技術振興機構(JST) 創発的研究支援事業 JPMJFR2122
研究代表者:明石 知子 (横浜市立大学 大学院生命医科学研究科 教授)
日本学術振興会(JSPS) 挑戦的研究(萌芽)JP21K19236; 新学術領域研究(研究領域提案型) JP19H05774
研究代表者:稲葉 謙次 (九州大学 生体防御医学研究所 教授)
国立研究開発法人日本医療研究開発機構 革新的先端研究開発支援事業24gm1410006h9904
研究代表者:倉持 円来 (東北大学 大学院生命科学研究科 特別研究員(DC2))
日本学術振興会(JSPS) 特別研究員奨励費 JP25KJ0595
本論文は『東北大学2025年度オープンアクセス推進のためのAPC支援事業』の支援を受け、Open Accessとなっています(10.1038/s41556-025-01794-8)。
【用語説明】
注1. 准教授(国際卓越研究者:ディスティングイッシュトアソシエイトプロフェッサー)
国際的に卓越した研究成果を創出する研究者として、国際卓越研究大学の認定後に採用された独立研究者(PI:Principal Investigator)を指す。
注2. 小胞体
細胞内小器官のひとつであり、分泌タンパク質や膜タンパク質が合成される。この区画で、分泌タンパク質は酵素依存的に糖鎖修飾やジスルフィド結合(注6)形成を受ける。小胞体内は他の細胞内小器官に比べ、カルシウム濃度が約1000倍程度高いことも知られる。
注3. 相分離
細胞内でタンパク質や核酸などの生体分子が特定の条件下で互いに集まり、液滴(ドロプレット)などの膜を持たない高次会合体を作る現象。この液滴は、溶液の性質を示しながら、細胞内で特定の機能を担う「膜のない細胞内小器官」のように機能すると考えられており、遺伝子発現の制御、シグナル伝達、タンパク質品質管理など、様々な生命現象を制御する役割を果たす。
注4. 神経変性疾患
中枢神経を構成する特定の細胞群が死ぬために発症する脳神経疾患のひとつ。構造異常タンパク質の蓄積や沈着が神経細胞群の死を引き起こす主要因のひとつと考えられている。
注5. プロテインジスルフィドイソメラーゼ(PDI)ファミリー
ジスルフィド結合(注6)の形成、組み換え、開裂を担う小胞体中に存在する酵素群のこと。ヒト細胞の小胞体中では20種類以上のPDIファミリータンパク質が存在する。
注6. ジスルフィド結合
空間的に近接する2つのシステイン残基のチオール官能基(—SH)が酸化され、硫黄原子間で架橋される共有結合。タンパク質の立体構造形成を安定化する役割や活性酸素種を捕獲する役割などがある。
注7. シャペロン
タンパク質の立体構造形成を助ける分子の総称。多くは、タンパク質の凝集を抑制する役割を有する。「シャペロン」とはルノワールの絵でも描かれているように、フランス語で若い女性が社交界デビューする際の介添人を意味する。
【論文情報】
タイトル:Ca2+-driven PDIA6 biomolecular condensation ensures proinsulin folding
(プロインスリンのフォールディングを保証するカルシウム駆動型PDIA6相分離)
著者: *#Young-Ho Lee, *#Tomohide Saio, #Mai Watabe, #Motonori Matsusaki, #Shingo Kanemura, #Yuxi Lin, #Taro Mannen, #Tsubura Kuramochi, #Yuka Kamada, Katsuya Iuchi, Michiko Tajiri, Kotono Suzuki, Yan Li, Yunseok Heo, Kotone Ishii, Kenta Arai, Kazunori Ban, Mayuko Hashimoto, Shuichiro Oshita, Satoshi Ninagawa, Yoshikazu Hattori, Hiroyuki Kumeta, Airu Takeuchi, Shinji Kajimoto, Hiroya Abe, Eiichiro Mori, Takahiro Muraoka, Takakazu Nakabayashi, Satoko Akashi, Tsukasa Okiyoneda, Michele Vendruscolo, Kenji Inaba, and *Masaki Okumura.
#共同筆頭著者
*責任著者:
東北大学 学際科学フロンティア研究所(兼)大学院生命科学研究科 動的構造生化学分野 准教授(国際卓越研究者:ディスティングイッシュトアソシエイトプロフェッサー) 奥村 正樹
掲載誌:Nature Cell Biology
DOI:https://doi.org/10.1038/s41556-025-01794-8
URL:https://www.nature.com/articles/s41556-025-01794-8
リリースカテゴリのその他の記事
- Youtubeチャンネル【10年後に小学校を創ろうプロジェクト】今週の「ミス日本と学ぶ」は健康習慣。精神科医が教員のメンタル不調の原因と森林浴の健康効果を解説
- 【営業・マーケ責任者必見/12月11日(木)19:00】年末商戦の成果を左右する!SNS×CRMで“関係を売上に変える”最新戦略を公開|無料オンラインセミナー
- 「来島美幸の婚活チャンネル」がYouTube登録者15万人、総再生数1億回をW達成
- ミクロン銅粉を使用したペーストによる印刷方式のRFIDアンテナ製造技術を新開発 純金属に迫る導電性、量産性と低コストも実現し2026年に実用化へ
- 生成AI技術で柔軟性の高い異常監視を実現 「ANOMALY WATCHER」とVLMの連携により新たな検知手法を提供